正極の電気化学活性 P2-Nax[Mg0.33Mn0.67]O2 ナトリウムイオン電池の材質
著者: ZHANG Xiaojun1、LI Jiale1,2、QIU Wujie2,3、YANG Miaosen1、LIU Jianjun2,3,4
1.バイオマスのクリーン変換と高価値利用のための吉林省科学技術センター、東北電力大学、吉林省132012、中国
2.中国科学院上海陶磁器研究所、高性能セラミックスおよび超微細微細構造の国家重点実験室、上海 200050、中国
3.中国科学院大学材料科学および光電子工学センター、北京 100049、中国
4.中国科学院大学杭州高等研究院化学材料科学院、杭州市 310024、中国
要約
低コストと幅広い原材料の流通という利点を活かし、 ナトリウムイオン電池は、次のような用途に最適な代替材料と考えられています。 リチウムイオン電池の正極材。 P2 相では NaMnO2 が層状になっています 構造、遷移金属層の二元固溶体は効果的に 電極材料の電気化学的性能を向上させます。この中で 研究、Mg イオンを含む Nax[Mg0.33Mn0.67]O2 の構造モデル 固溶体はクーロンモデルを使用して構築されました。の 第一原理計算により、Nax[Mg0.33Mn0.67]O2 の放電電圧は瞬間で 3.0 V に達することが明らかになりました。 ナトリウムイオン含有量が0.67未満。電子の状態密度と電荷 母集団分析により、Mg の固溶体がアニオン性物質の活性化を引き起こすことが示されました。 変態した P2 相 Nax[Mg0.33Mn0.67]O2 における格子酸素の電気化学的活動 カチオン系とアニオン系の電気化学反応機構 相乗的な酸化還元反応から可逆的なアニオン酸化還元反応。これ 変換は電極材料の設計に新しい方法を提供します Na イオン電池の最適化と、 他のイオン電池の探査。
キーワード - ナトリウムイオン電池; 電気化学 活動 ; 第一原則。 アルカリ金属ドーピング
TOB NEW ENERGY は、電池材料、電池機械、電池生産ライン ソリューション、および固体電池用の電池技術のフルセットを提供します。ナトリウムイオン電池およびリチウムイオン電池の製造。
Berthelotら[10]は次のことを発見した。 単一の遷移金属 (TM) であるナトリウムを含む層状酸化物 NaTMO2 純粋なナトリウム層ではイオンと空孔が規則的に配列され、その結果、多くの 放電プロセス中のこのタイプの酸化物の電圧プラットフォーム。 。これ その結果、比容量が急速に減衰し、 サイクル性能に優れているため、このタイプの酸化物のエネルギー変換効率は次のようになります。 低い。固溶元素が遷移金属層に導入され、 二元または多元素の遷移金属の混合配置を形成します。の 電極材料には無秩序な電荷が多数含まれており、 上記の電圧プラットフォームを効果的に抑制し、エネルギー変換を向上させます。 効率。 Yabuuchi et al. [11] は Na2CO3、(MgCO3)4Mg(OH)2・5H2O を使用 原料としてMnCO3を使用します。固相反応を900℃で3時間実施した。 二元不規則な P2 相 Na2/3[Mg1/3Mn2/3]O2 電極を得るのに 12 時間 Mg固溶体を配合した素材です。彼らは、電流密度10で次のことを発見しました。 mA/g、調製された P2 相の初期比容量 Na2/3[Mg1/3Mn2/3]O2 正極材料は約 150 mAh/g でした [11]。わずかに Na2/3MnO2 の比容量 (184 mAh/g) よりも低い。 Bruce et al.[12]は、格子の電気化学反応が存在することを発見しました。 P2 相の酸素 Na2/3[Mg1/3Mn2/3]O2、酸素析出はありませんでした。 観察された。 Mgの導入によりサイクル可逆性が向上することが示されています。 材料の可逆的な比容量。ただし充電中は と放電過程、微細な電気化学反応機構 この系の格子酸素はまだ不明であり、そのメカニズムは Mg固溶体が系の安定性を向上させることも不明である。
したがって、この作業には P2 フェーズがかかります Nax[Mg0.33Mn0.67]O2を研究対象とし、第一原理を採用 密度汎関数理論 (DFT) の計算方法。に関する体系的な研究 放電の電気化学的活性と構造安定性 Mg固溶体を含むNax[Mg0.33Mn0.67]O2正極材料の性能 イオンを実施しました。電極の微細な仕組みを解明するために 電子のミクロスケールでの電気化学反応における材料と 原子、電気化学を理解するための参考資料となります。 新しい材料のプロセスと設計。
1 計算方法
この作業での計算は以下に基づいています 密度の平面波基礎ソフトウェア VASP パッケージ[13,14] 機能理論。加算的平面波法が使用されており[15]、 交換相関汎関数は一般化された勾配近似です (GGA) Perdew-Burker-Ernzerhof の形式で。ハバード パラメータ U は、Mn の d 電子を補正するために導入され、実効 U 値は 3.9 eV [17,18]。下部平面波のカットオフエネルギー は600eVです。イオン緩和が完了すると、すべての原子にかかる力が小さくなります。 0.1eV・nm-1より。結晶構造を最適化する場合、3×3×1 (72 原子) スーパーセル構造を採用、格子定数は0.874nm×0.874nm×1.056 nm、ブリルアン ゾーンの k 点グリッドは 3×3×3 です [19]。の フローズンフォノン法を使用して、格子振動スペクトルを計算しました。 Phonopy ソフトウェア パッケージ。定期的な影響を避けるために 境界条件では、3 × 3 × 1 スーパーセル構造を使用して計算されました。 P2相NaMnO2とNa[Mg0.33Mn0.67]O2の力定数とフォノンスペクトル。 点電荷クーロン モデルを使用して、イオン占有率を迅速に計算します。 デナトリウム構造と最も低い Na 占有配置の クーロンエネルギーは、より正確な第一原理計算のために選択されます[20]。 電極材料の放電電圧は次のように表すことができます[20]:
$V=-\frac{G(\text{N}{{\text{a}}_{{{x}_{2}}}}\text{M}{{\text{O} }_{2}})-G(\text{N}{{\text{a}}_{{{x}_ {1}}}}\text{M}{{\text{O}}_{2}})-({{x}_{2}}-{{x}_{1}})G(\テキスト{Na})}{({{x}_{2}}-{{x}_{1}}){{e}^{-}}}$
ここで、G は、 対応するシステム、e- は元素電荷です [21]。
2 結果と考察
2.1 微細構造特性と 構造安定性
P2 相 NaMnO2 の空間群 構造は R$\bar{3}m です (図 1)[22,23]。空間構成 Mg 固溶体 Na0.67[Mg0.33Mn0.67]O2 の構造は、 NaMnO2。 Mg イオンは、遷移金属層内の Mn イオンの 1/3 を置き換えます。の Mg と Mn の理論上のイオン比は 1:2 です。実験による特性評価が判明 この比率では、Nax[Mg0.33Mn0.67]O2 構造内の Mg イオンのみが形成されるということです。 Mn の配列が乱れ、Na 層の秩序が保たれます[24]。 イオン比 Mg:Mn1:2 の場合、Mg、Na、Mn は無秩序なイオンを形成します。 カチオンの配置。図 1(A) に示すように、格子の積層モードは 酸素はABBA...、MgとMnはそれぞれ間の八面体サイトを占めます。 酸素 AB 層、Na は酸素 AB 層間の三角プリズム サイトを占めます。 酸素 AA および BB 層[25、26]。図 1(B) に示すように、 遷移金属層におけるMgとMnのハニカム配置[27]、 これは、リチウムに富む化合物における Li と Mn 間の配置に似ています [28]。 [MgO6] 八面体は、6 つの [MnO6] 八面体が共有して配置されています。 エッジ[29,30]。のアルカリ金属層では、 Na0.67[Mg0.33Mn0.67]O2構造では、ナトリウムイオンの格子点が2つあります。 1つは[MgO6]または[MnO6]八面体の上下層で配置されています エッジを共有すること。もう 1 つは、上層と下層が同一平面上に配置されています。 [MgO6] または [MnO6] 八面体。
![Fig. 1 Schematic diagram of P2-Na2/3[Mg1/3Mn2/3]O2 Fig. 1 Schematic diagram of P2-Na2/3[Mg1/3Mn2/3]O2](/js/htmledit/kindeditor/attached/20231108/20231108103040_37156.webp)
図。 1 P2-Na2/3[Mg1/3Mn2/3]O2の模式図
ナトリウムイオンが異なる構造内 ナトリウムイオンは、Mn と Mg の間のクーロン相互作用の影響を受けます。 遷移金属層にはNaイオンが、アルカリ金属層にはNaイオンが存在します。 2 つの異なる占有モード。そこで、本作ではまずクーロンを利用する。 P2 相 Na0.67[Mg0.33Mn0.67]O2 構成を迅速に選別するモデル クーロンエネルギーが最も低い。合理性を検証するために、 これらのスクリーニングされた構成の XRD パターンを計算およびシミュレートし、 それらを測定結果と比較しました[11]。結果が表示されます 図 2 では、計算された (016) と (110) がわずかに右にシフトされています。 実験による特性評価と比較すると、主に 一部の結晶面には非晶質構造や欠陥構造が存在します。 実験的に準備された材料。計算モデルの構造は次のとおりです。 完全な結晶構造であるため、XRD 間には一定の偏差が存在します。 計算シミュレーションの広がりとピーク強度、 実験結果。また、これらにはNaイオンの配列があります。 2 つの結晶面と Na イオンの挿入と脱離は別の動作です 対応するピーク位置のシフトの考えられる理由。後 上記の効果を考慮して、シミュレートされたピークの形状と強度 XRD は実験結果と一致しており、構築されたモデルは 実験で微細構造情報を再現し、 理論的にスクリーニングされた構造は比較的正確で信頼性があります[31,32]。
![Fig. 2 Comparison of calculated and experimental XRD patterns of Na0.67[Mg0.33Mn0.67]O2 Fig. 2 Comparison of calculated and experimental XRD patterns of Na0.67[Mg0.33Mn0.67]O2](/js/htmledit/kindeditor/attached/20231108/20231108103050_54123.webp)
図。 2 計算XRDと実験XRDの比較n Na0.67[Mg0.33Mn0.67]O2のパターン
マグネシウム固体の効果を研究するために 構造安定性に関するソリューションでは、第一原理と次のことを組み合わせて使用しました。 格子振動スペクトルを計算する「凍結フォノン法」 P2-NaMnO2 および P2-Na[Mg0.33Mn0.67]O2。図 3 に示すように、所有者波は はブリルアン ゾーン全体に虚数周波数を持たないことを示しています。 P2-Na[Mg0.33Mn0.67]O2は動的安定性を持っています。のフォノンスペクトルを比較すると、 2 つの材料では、Mg のドーピングによって特性が大きく変化しないことがわかりました。 振動周波数範囲が広く、格子振動にはほとんど影響を与えませんでした。の Mg ドープ構造も良好な動的安定性を示しました。さらに、ブルースらは、 アル。 Mg固溶体を用いたP2相Na[Mg0.33Mn0.67]O2の調製に成功、 これは、材料が追加の熱力学を備えていることをさらに実証しました。 安定性。したがって、P2-Na[Mg0.33Mn0.67]O2 が 良好な構造安定性。
![Fig. 3 Phonon dispersion curves of (A) NaMnO2 and (B) Na0.67[Mg0.33Mn0.67]O2 Fig. 3 Phonon dispersion curves of (A) NaMnO2 and (B) Na0.67[Mg0.33Mn0.67]O2](/js/htmledit/kindeditor/attached/20231108/20231108103102_42296.webp)
図。 3 (A) NaMnO2 および (B) Na0.67[Mg0.33Mn0.67]O2 のフォノン分散曲線
2.2 電気化学的特性の分析 P2 相 Nax[Mg1/3Mn2/3]O2
Mgドーピングの効果を調べるため 材料の電気化学的特性に基づいて、放電を計算しました。 Mg固溶体構造P2-Nax[Mg0.33Mn0.67]O2の電圧(図4)。の Na イオンの濃度範囲は実験的に決定されます。 0.11 x 0.66[11]。図 4(A) は、 放電プロセスとそれに対応する電圧 (図 4(B)) には主に以下が含まれます。 3 つのプラットフォーム: 3.4、2.9、2.1 V。予測される理論上の容量は 152 mAh/g、これは基本的に実験結果と一致しています[11]。 第一原理から計算された放電電圧曲線はわずかに異なります。 実際の測定結果よりも高くなります。主な理由は、まず第一に、 原理計算は実験測定の影響を無視します 電解液、リチウムイオン伝導度などの実験条件 私たちの以前の研究では、[33]次のことが示されています。 計算された放電電圧曲線は、 実験的に測定された曲線では、全体的な変化傾向は一貫しています。 したがって、放電プロセス全体を通じて、 Nax[Mg0.33Mn0.67]O2 の電圧は実験結果と一致しています [12,20]。 x<66% の場合、Nax[Mg0.33Mn0.67]O2 は約 3.0 V の高電圧を持ち、明らかな追加の電圧プラットフォームはありません。これは、Mn3+ の Mg2+ の置換がナトリウムイオンの再配列を抑制する効果があることを示しています。構造的な相変化。 NaMnO2 やその他のシステムに関するこれまでの充放電研究では、遷移金属の規則正しい配置には、通常、より多くの電圧プラットフォームが伴うことがわかっています。
![Fig. 4 (A) DFT-calculated structural changes and (B) discharge voltage curve of P2-Nax[Mg0.33Mn0.67]O2 during discharge Fig. 4 (A) DFT-calculated structural changes and (B) discharge voltage curve of P2-Nax[Mg0.33Mn0.67]O2 during discharge](/js/htmledit/kindeditor/attached/20231108/20231108103110_90088.webp)
図4 (A) DFT で計算された構造変化と (B) 放電中の P2-Nax[Mg0.33Mn0.67]O2 の放電電圧曲線
理想的な状況下では、原子価は Na2/3[Mg0.33Mn0.67]O2 中の Mg と Mn の状態はそれぞれ +2 と +4 であり、 より高い原子価状態に酸化され続けることはできません。したがって、 システム内のカチオンの電気化学的活動と充放電 材料のプロセスはアニオン電気化学反応です。 Na0.67MnO2では、 Mn イオンの初期価数状態は +3.33 です。充電プロセス中、Mn イオンは 0.67 個の電子を外側に移動させて、+4 の安定した価数に達します。で 今度は、すべての Na+ が放出され、格子酸素は一度も放出されませんでした。 電気化学反応に参加した[34]。したがって、 Na0.67MnO2の充放電過程はカチオンとして現れる 電気化学反応。多くの研究で、 格子酸素によって失われる電子は 0.33 未満であり、アニオン電気化学 反応は良好な可逆性を持っています[11-12,28]。過剰な酸化は 酸素陰イオンの減少(失われた電子の数が 0.33 を超える)により、 酸素の電子配置が st から逸脱する8カプラールールが可能、 その結果、不可逆的な変換反応が起こり、 オーオーの絆。酸素の発生や不可逆的な電荷を引き起こす可能性さえあります。 電極構造の放電[27,35]。で 電荷損失の限界状態を考慮した場合、Na0.67[Mg0.33Mn0.67]O2。それ つまり、Na イオンが完全に分離されて Na0[Mg0.33Mn0.67]O2 が形成されるときです。 構造上、Mg と Mn は常に +2 と +4 の価数を維持します。 Oアニオンは -1.67 価数まで酸化され、0.33 個の電子が失われますが、これは限界値よりも低いです 不可逆的なアニオン電気化学反応。したがって、全体としては、 Na0.67[Mg0.33Mn0.67]O2のc充電反応、格子酸素は必要ありません 空間的に再構成され、電気化学反応は可逆的です。 Mg2+ の導入により、可逆的な比容量が維持されるだけでなく、 だけでなく、材料のエネルギー密度も増加します。 放電電圧
電気化学的性質を証明するには 放電中の Nax[Mg0.33Mn0.67]O2 材料内の酸素の活性 このプロセスで、電子状態密度 (図 5) を計算しました。 材料の初期および最終の放電構造。判明したのは、 放電プロセス中に、Na イオンが徐々に埋め込まれ、総数 系内の電子の数が増加し、フェルミ準位がより高いレベルに移動しました。 エネルギーレベル。 O2p軌道の穴の数は徐々に減少し、 これは、系に入った電子が空の空間に移送されることを示しています。 格子酸素の軌道が変化し、格子酸素が還元されます。その間、 電極材料の放電プロセスでは、格子酸素が関与します。 陰イオンの電気化学反応。この時点ではほとんど変化なし Mn-d 軌道電子内にあり、電荷の移動はありません。 Mn の価数状態は放電プロセス中に変化しないことが証明されています。 Mn は電気化学的に活性ではありません [12,36]。ただし、その間、 P2-NaxMnO2 の放電プロセス、電子が高エネルギー Mn を満たし続ける および O の空の軌道は、Mn と O の両方が電気化学的に存在することを示しています。 活発であり、アニオンとカチオンが協力する典型的な電気化学反応です。
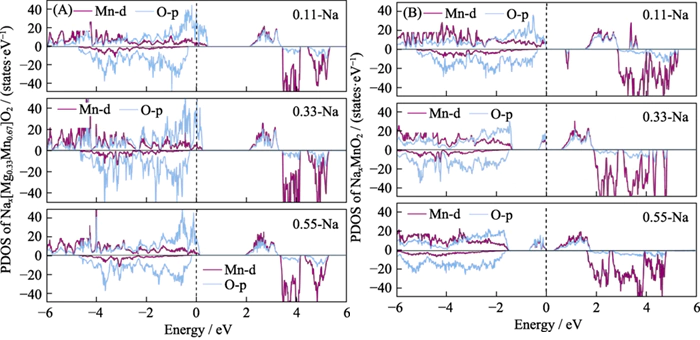
図5 異なる Na イオン下での (A) P2-Nax[Mg0.33Mn0.67]O2 および (B) P2-NaxMnO2 の電子状態密度 放電中の内容
PDOS: 予測 状態密度
一貫した結論を導き出すことができる 電荷集団分析による (図 6)。排出プロセス中に、 Nax[Mg0.33Mn0.67]O2では、Mnイオンの電荷量は基本的に変化しないので、 電気化学反応には関与しません。の過程で Na 含有量を 0.11 から 0.66 に増加すると、O イオンは約 0.2e- になりました。 顕著な電荷充填が発生し、アニオン性電気化学活性を示しました[37]。 P2-NaxMnO2 の電荷集団分析により、次のことがわかりました。 Na 含有量が増加すると、Mn と O が共同で関与することになります。 電気化学反応。この結果は次の分析と一致しています。 電子状態密度。 Mgが固溶していることが証明されています。 システムの電気化学反応機構をアニオンから変化させ、 カチオン:可逆的アニオンに対する協調的な電気化学反応 このプロセスは電気化学反応に影響を与えず、 材料の放電可逆性。
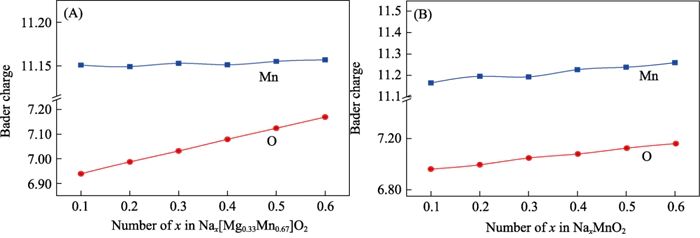
図。 6 充電 異なるナトリウムイオン下での (A) Nax[Mg0.33Mn0.67]O2 と (B) P2-NaxMnO2 の分析 内容
3 結論
この研究では第一原理が使用されました 微細構造特性を体系的に研究するための計算、 Mg2+固溶体P2の速度論的安定性と電気化学的活性 Nax[Mg1/3Mn2/3]O2相。 Mg2+ の導入により電気化学的変化が起こります。 アニオンおよびカチオン協同組合からの材料の反応タイプ NaxMnO2 の可逆アニオン電気化学的電気化学反応 Nax[Mg0.33Mn0.67]O2の反応。 P2-Nax[Mg0.33Mn0.67]O2 の O アニオンの場合 電気化学反応に関与する場合、電荷の増加と損失の範囲は次のとおりです。 0.33未満であり、可逆性が良好です。 Mg2+の導入だけではない 材料の放電電圧を高めますが、同時に放電電圧を維持します。 材料の可逆的な比容量が増加し、最終的には 材料のエネルギー密度。
ナトリウムイオン電極材料では、 遷移金属にアルカリ土類金属を導入するカチオン用アル層 固溶体は、新しい材料性能最適化戦略です。その基本 メカニズムは、アニオンを犠牲にすることによってアニオンの電気化学的活動を引き起こすことです。 カチオンの電気化学的活動、電気化学反応の変化 材料のメカニズムを解明し、放電電圧を高め、最終的には 材料のエネルギー密度を最適化します。この戦略は提供するだけでなく、 ナトリウムイオン電池用電極材料の新しい設計手法、 だけでなく、他のイオンの最適化と探索のための新しいアイデアも提供します 電池
参考文献
[1] フー・インイン、ウェン・チャオイン、ルイクンほか アル。最先端の ナトリウム電池の研究開発状況。エネルギー貯蔵 科学とテクノロジー、2013、2(2):81-90.
[2] シェン・グアンイェ、リーチェン、シュー・ビンリャン、他 アル。経済的配分 風力発電を考慮したエネルギー貯蔵システム向け。ジャーナル・オブ・ノースイースト 電力大学、2018、38(4):27-34.
[3] MA CHAO、ZHAO XIAO-LIN、KANG LITAO、他 アル。非共役 電気化学セル用のジカルボン酸アノード材料。アンジュー。化学。内部。編、2018、57(29):8865-8870.
[4] リチャーズ W D、DACEK S T、KITCHAEV D A、他。のフッ素化 リチウム過剰の遷移金属酸化物正極材料。先進エネルギー 資料、2018、8(5):1701533.
[5] シャン・シンデ、チャン・カイ、チェン・ジュン。最近の進歩と ナトリウムイオン電池の正極材料の展望。上級メーター、2015、27(36):5343-5364.
[6] 馬超、趙暁林、ハリス M M, et al.尿酸としては ナトリウムイオン電池用の電気化学的に活性な化合物: β-共役と安定化炭素アニオンの段階的 Na+ 貯蔵メカニズム。 ACS アプライド マテリアルズ & インターフェース、2017、9(39):33934-33940.
[7] リー D H, XU JING, MENG Y S. 先進的なカソード 高レートで優れた構造安定性を備えた Na イオン電池向け。物理学。化学。化学。 物理学、2013、15(9):3304-3312.
[8] 久保田 和人、薮内 伸、吉田 英 ほか アル。層状酸化物として Naイオン電池用正極材料。 MRS 速報、2014 年、39(5):416-422.
[9] クラムメント R J、BRUCE P G、GREY C P. レビュー – マンガン ナトリウムイオン電池正極材料としての P2 型遷移金属酸化物ベース。のジャーナル 電気化学協会、2015、162(14):A2589-A2604.
[10] BERTHELOT R、CARLIER D、DELMAS C. 電気化学 P2-NaxCoO2 状態図の調査。ナット。メーター、2011、10(1):74-80.
[11] 薮内 伸、原 良、久保田 和 他 アル。新しい電極 充電式ナトリウム電池の材料: 異常に高い P2 タイプ Na2/3[Mg0.28Mn0.72]O2 可逆的な容量。 J. メーター。化学。 A、2014、2(40):16851-16855.
[12] マイトラ U、ハウス R A、サマービル J W、他。酸素酸化還元 Na2/3[Mg0.28Mn0.72]O2中の過剰なアルカリ金属イオンを含まない化学。ナット。 Chem.、2018、10(3):288-295.
[13] GUO SHAO-HUA、SUN YANG、YI JIN 他 アル。理解 実験による層状 P2 および P3 酸化物におけるナトリウムイオンの拡散 第一原理計算: 結晶構造と結晶構造の間の橋渡し 電気化学的性能。 NPG アジア マテリアルズ、2016、8:e266.
[14] ジ・フイウェイ、キッチャエフ D A、LUN ZHANG-YAN、他計算的 無秩序な大容量リチウムイオンの研究と実験的実現 Ni酸化還元ベースのカソード。の化学 資料、2019、31(7):2431-2442.
[15] LEE J、URBAN A、LI XIN 他 アル。ロックを解除する 充電式リチウム電池用のカチオン無秩序酸化物の可能性。サイエンス、2014、343(6170):519-522.
[16] URBAN A、LEE J、CEDER G. 構成 高容量リチウム電池電極用の岩塩型酸化物の宇宙。先進エネルギー 資料、2014、4(13):1400478.
[17] チャクラボルティ A、ディクシット M、アウルバッハ D、他 アル。正確な予測 SCANメタ-GGA密度を使用した層状酸化物材料のカソード特性 機能的。 npj 計算 資料、2018、4:60.
[18] アーバン A、アブデラヒ A、DACEK S、他 アル。電子構造 遷移金属酸化物におけるカチオン障害の原因。物理学。 Rev. Lett.、2017、119(17):176402.
[19] アサット G、タラスコン J・M・ファンダメンタル リチウムイオンのアニオン酸化還元活性の理解と実際的な課題 電池。自然エネルギー、2018、3(5):373-386.
[20] 薮内 伸、中山 正、竹内 正 他 アル。の由来 酸化物イオンの固体酸化還元反応における安定化と不安定化 リチウムイオン電池用。ナット。 Commun.、2016、7:13814.
[21] SANNYAL A、AHN Y、JANG J. 第一原則 陽極材料としての二次元シリゲン(2D SiGe)の研究 アルカリ金属イオン電池。計算的 材料科学、2019、165:121-128.
[22] リー・ホン、フー・ヨンシェン、パン・ホイリン、他 アル。研究の進捗状況 室温ナトリウムイオン蓄電池の電極材料構造。中国科学 Chimica、2014、44(8):1269-1279.
[23] ワン・ユエシェン、シャオ・ルイ・ジュアン、フー・ヨンシェン、他 アル。 P2-Na0.6[Cr0.6Ti0.4]O2 カチオン無秩序電極 高速対称充電式ナトリウムイオン電池用。ナット。 Commun.、2015、6:6954.
[24] 王秦超、孟京柯、岳信洋ら アル。 P2構造のチューニング Naイオン電池用のNaサイトMg置換による正極材料。 J.Am.化学。 Soc.、2019、141(2):840-848.
[25] メンディボール A、デルマス C、ハーゲンミュラー C. 電気化学 NaxMnO2ブロンズのインターカレーションとデインターカレーション。 Academic Press、1985、57(3):323-331.
[26] サマービル J W、SOBKOWIAK A、TAPIA-RUIZ N、他の性質 層状Naイオン電池の正極におけるZ相。エネルギー & 環境科学、2019、12(7):2223-2232.
[27] QU JIE、 WANG DONG、 YANG ZU-GUANG、 et アル。イオンドーピング 部位変動による複合カソード調整: のケーススタディ Na/Mn サイトに Mg2+ をドーピングした層トンネル Na0.6MnO2。 ACS アプリケーション。メーター。 インターフェース、2019、11(30):26938-26945.
[28] SATO T、SATO K、ZHAO WEN-WEN 他 アル。準安定性と ナノサイズの陽イオンが乱れた岩塩型酸化物: 化学量論の再考 LiMnO2 と NaMnO2。材料ジャーナル 化学 A、2018、6(28):13943-13951.
[29] ギニャール M、デルマス C. バッテリーを使用して 新しいバナジウム酸化物を合成します。ケミストリー セレクト、2017、2(20):5800-5804.
[30] ワン・ペンフェイ、ヤオ・フーロン、リウ・シンユウ、 、他。 Na+/空孔の無秩序化により、高レートの Na イオン電池が期待できます。 Science Advances、2018、4(3): eaar6018.
[31] キム・H、キム D J、SEO D H、他ナトリウムイオン電池のNa0.44MnO2におけるナトリウムインターカレーションと中間相の非経験的研究。の化学 資料、2012、24(6):1205-1211.
[32] LI XIN、MA XIAO-HUA、SU DONG、他 アル。直接的な可視化 Na5/8MnO2 における Na 秩序と結合したヤーン・テラー効果の影響。ナット。メーター、2014、13(6):586-592.
[33] ワン・ヨウウェイ、ワン・ジュンカイ、チャオ・シャオリン、他 アル。料金を減らす バンドアライメントカソード設計により、Li-O2 バッテリーの過電圧を抑制します。エネルギー & 環境科学、2020、13(8):2540-2548.
[34] ZHENG C、RADHAKRISHNAN B、CHU I H, et al.の影響 Na の秩序化と層状 P2 酸化物の反応速度論における遷移金属の混合。物理的なレビュー 適用済み、2017、7(6):064003.
[35] LUN ZHENG-YAN、OUYANG B、CAI ZI-JIAN 他 アル。設計原則 高容量のマンガンベースの陽イオンが乱れた岩塩陰極。化学、2020、6(1):153-168.
[36] SEO D H、LEE J、URBAN A、他構造的かつ 層状およびカチオン無秩序における酸素酸化還元活性の化学的起源 リチウム過剰の正極材料。ナット。 Chem.、2016、8(7):692-697.
[37] BAI QIANG、YANG LU-FENG、CHEN HAI-LONG、他 アル。計算機研究 ナトリウムイオン電池の電極材料の研究。先進エネルギー 資料、2018、8(17):1702998.