デュアルリチウム塩ゲル 複合電解質:リチウム金属電池yにおける調製と応用
郭玉祥、黄 李強、王剛、王紅志。 デュアルリチウム塩ゲル複合体 電解質: リチウム金属電池の調製と応用。 ジャーナル 無機材料、2023、38(7): 785-792 DOI:10.15541/jim20220761
要約
金属リチウムは、高エネルギー密度のリチウムイオンにとって理想的な負極の 1 つです。 高い理論比容量、低い還元電位によるバッテリー 豊富な埋蔵量も。ただし、Li アノードの用途には次のような問題があります。 従来の有機液体電解質とは重大な相溶性がありません。ここで、 金属Liとの相溶性が良好なゲル複合電解質(GCE) アノードはその場重合によって構築されました。ダブル 電解質に導入されたリチウム塩システムは、 ポリマー成分。電解質の電気化学ウィンドウを広げます。 市販の電解液の3.92Vに比べ5.26Vと高イオン性が得られます。 30°Cでも1×10-3S・cm-1の導電率を示します。の結果 Liアノード表面の形態特性評価と元素分析は次のことを示しています GCE は、以下の条件下でリチウム金属に対して明らかな保護効果を発揮します。 二重リチウム塩系の条件と体積効果とデンドライト成長 Li アノードの反応は明らかに抑制されます。同時に、リチウム金属が完全に 市販のリン酸鉄リチウム (LiFePO4) 正極材料で組み立てられたバッテリー、 優れたサイクル安定性とレートパフォーマンスを発揮します。容量 バッテリーの保持率は一定で 200 サイクル後に 92.95 % に達します 25 °C で 0.2C (1C = 0.67 mA·cm-2) の電流。この研究が示しているのは、 GCE が安全性、安定性、包括的な機能を効果的に向上させることができること リチウム金属電池の電気化学的性能は、 普遍的な擬固体電解質設計の戦略を提供します。
キーワード-金属リチウム; その場重合; ゲル複合体 電解質
「ダブルカーボン」という目標が掲げられて以来、 2020年に向けて、中国は前例のないエネルギーシステム改革に直面している。中国 今後30年間で炭素排出量の大幅な削減を完了する必要がある、 そしてグリーンエネルギーは「独占」に取って代わるまで徐々に強化されるだろう 伝統的な化石エネルギーの位置づけ。再生可能エネルギーの重要な部分として エネルギーシステム、リチウムイオン電池技術が広く注目を集めています 出てきたら注目。現在では主力エネルギーであることに加え、 3C電子製品のデバイス、リチウム電池の応用 自動車産業、航空宇宙、スマートグリッドの分野は徐々に これにより、そのパフォーマンスに対する要求がさらに高まります。で 航続距離を長くするには、リチウム電池を使用する必要があります。 より高いエネルギー密度を備えたバッテリーシステムを開発します。その中でもリチウム金属は 超高比容量 (3860 mAh g-1) と低い還元電位を備えています。 (-3.04 V (vs SHE))は次世代の負極材料として期待されています 高エネルギー密度バッテリーのこと。ただし、リチウム金属が接触すると 有機液体電解質を使用すると、副反応が発生し続けます。 界面を貫通し、制御不能なリチウム樹枝状結晶の成長を引き起こします。 バッテリーの内部セパレーターがショートを引き起こし、安全性さえも低下させます。 問題。この欠陥に対応するには、通常、ソリッドを使用することが考えられます。 液体電解質の代わりに電解質を使用してバッテリーの安全性を向上させます。 ただし、室温でのイオン伝導性が低く、界面活性が低いため、 互換性は、さらなる開発と応用を著しく妨げます。
このような背景から、ゲル状態 界面接触とイオン伝導性のバランスをとることができる電解質 ますます注目を集めています。 Tan Shuangjie らは、 難燃剤を固定化して不燃性のゲル状電解質とした ポリビニレンカーボネートのポリマーマトリックス中の有機リン酸塩 機械的強度。電解質には高イオン性という利点があります。 導電性とリチウムイオン移動度、不燃性、高い機械的特性 強度があり、電気化学的適合性が良好です。さらにジェルは その場重合によってバッテリー内部で形成された電解質には、 低粘度で扱いやすく、濡れ力が強いという特徴があり、 活性物質に完全に浸透し、理想的な界面を生成します。 接触することにより、良好なイオン移動経路が得られます。たとえば、Guo Yuguo 氏の 研究グループは、伝統的なエーテルベースのモノマー 1,3-ジオキソラン (1,3-ジオキソラン、 DOL) と 1,2-ジメトキシエタン (1,2-ジメトキシエタン、DME)、市販のリチウム リチウム塩としての六フッ化リン酸 (LiPF6) は開環を引き起こす可能性があります DOLの重合も同時に行い、新たなゲル状電解質を開発。 リチウム硫黄電池や市販の正極電池でも安定して動作可能 が得られました。ポリエーテルベースのポリマーは最も安定なポリマーの 1 つですが、 リチウム金属アノード用の電解質、その狭い電気化学ウィンドウ、 室温ではイオン伝導率が低いため、高エネルギーでの用途が制限される 密度の高いバッテリー。 LiPF6は理想的なイオン伝導性を持ち、優れたイオン伝導性を持っていますが、 電極の適合性が低いため、電気化学的安定性が低いという問題があります。 そこで、総合性に優れたゲル状電解質の開発を目指す。 パフォーマンスを向上させるには、適切なポリマーホスト、リチウム塩を選択する必要があります およびその他のコンポーネント。
お互いの関係のバランスをとるために 導電性、高電圧安定性、電極互換性など、 本研究では固液複合高性能GCEを開発した。の 熱開始in-situ重合法を採用、PEGDAを使用 モノマーとしてエチレンカーボネートとジエチルカーボネートの混合溶媒を使用した。 を追加し、リチウム二塩系としてLiTFSIとLiDFOBを導入 ポリマー成分と連携して作用します。改善しながら、 電気化学的性能、電解質間の界面安定性 リチウム金属アノードはさらに強化されています。
1 実験方法
1.1 GCE の準備
LiTFSI、LiDFOB、EC、DEC (蘇州多多) ケミカルテクノロジー株式会社)はすべて無水グレードの電池材料です。の EC 試薬と DEC 試薬を混合し、LiTFSI と LiDFOB を秤量し、 溶媒に溶かしたもの。調製した複塩系電解液(液体) 電解質、LE) は 1 mol/L LiTFSI の EC/DEC (体積比 1:1) 溶液でした。 および 0.2 mol/L LiDFOB。 PEGDA (â¥99%、Mn=400) およびアゾビスイソブチロニトリル (アゾジイソブチロニトリル、AIBN、98%) は Shanghai Aladdin Reagent から購入しました PEGDAとLEを混合してGCEの前駆体溶液を調製し、 PEGDAの質量分率は10%、20%、30%であった。 1%の質量分率を追加 熱開始剤 AIBN を加えてよくかき混ぜます。 PEGDA前駆体溶液を加熱した 70℃で2時間加熱し、完全に重合したPEGDAベースのゲル複合体を得る GCE-x (x=10、20、30) と名付けられた電解質。上記の実験は、 すべては無水かつ酸素のないグローブボックス内で実施される。
1.2 バッテリーの組み立て
CR2025 ボタン電池の電池アセンブリ (316 ステンレス鋼、SS)、リチウム金属シート(14mm×0.45mm、Li)、アルミ箔 (バッテリーグレード)。さまざまなテスト要件に従って、SS||SS バッテリー、 Li||SS電池、Li||Li電池、Li||LiFePO4電池を組み立てました。 グローブボックス。 LiFePO4、ケッチェンブラック、ポリビニリデンの質量比 正極材料中の二フッ化物 (PVDF) は 90 : 5 : 5 であり、面積容量は は0.67mAh・cm-2です。準備の詳細については、補足資料 S1 を参照してください。 正極シートの製造工程と電池の組み立て工程
1.3 材料の特性評価方法
官能基と化学物質 PEGDA モノマーとそのポリマーの構造は、サーモグラフィーを使用して分析されました。 NiColet iS50 フーリエ変換赤外分光計 (フーリエ変換) 赤外線分光計、FT-IR)、Thermo Fisher Scientific Corporation 製 米国、400 ~ 4000 cm-1 の波長範囲。の結晶化度 異なるポリマー含有量を含むゲル状電解質の特徴は次のとおりです。 Bruker AXS の D2 Phaser X 線回折計 (X 線回折計、XRD) ドイツの会社で、スキャン範囲は 2θ=5°~80°でした。 OCA40Microコンタクト 北京東方徳飛計器有限公司の角度測定器は、 異なるPEGDAを含む前駆体溶液の接触角をテストするために使用されます。 LiFePO4 電極シート表面の内容物。顕微鏡的な形態 リチウム金属シートの断面と表面を観察しました。 JElectronics JSM-7500F 電界放射型走査電子顕微鏡 (フィールド 放射型走査型電子顕微鏡、FESEM)。の要素情報は、 Escalab 250Xi X線を使用してリチウム金属シートの表面を分析しました Thermo の光電子分光計 (X 線光電子分光法、XPS) 米国のフィッシャー サイエンティフィック コーポレーション。
1.4 電気化学試験
電気化学的安定性ウィンドウ 電解液はリニアスイープボルタンメトリー (LSV) によってテストされ、電圧範囲は 開路電圧 (OCV) から 6 V まで、掃引速度は 1 mV·s-1 でした。の 電気化学インピーダンス分光法 (EIS) の周波数範囲は 10-2 ~ 106 Hz、 摂動電圧は 10 mV です。測定にはクロノアンペロメトリーが使用されました 電解液中のリチウムイオンの移動数、電位 差は 10 mV、時間は 800 秒、移動数は リチウムイオンの量は式(1)に従って得られました。
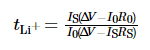
このうち、tLi+は、 リチウムイオン、ÎV は電位差、R0 と RS は界面 試験前後の電極と電解液のインピーダンス値、 それぞれ、I0 と IS は初期状態の電流と定常状態です。 それぞれ電流。上記のテストはすべて PARSTAT MC で実行されました。 米国AMETEK社のマルチチャンネル電気化学ワークステーション。 充放電サイクル性能 バッテリーは武漢のLAND CT3001A-1Uバッテリーテストプラットフォームを使用してテストされました ランディアン電子株式会社
2 結果と考察
2.1 の調製と構造解析 GCE
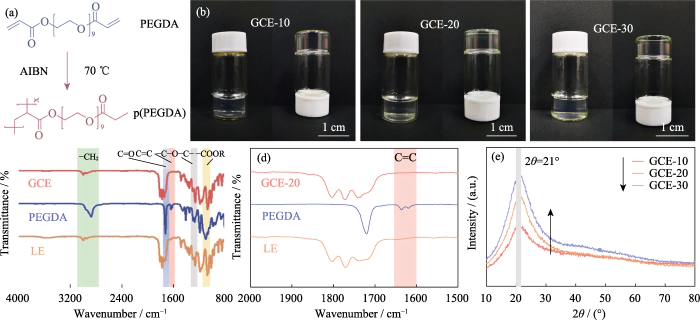
この研究では、PEGDA をモノマーとして使用しました。 重合開始剤としてAIBNを使用し、重合開始剤としてECとDECを導入しました。 可塑剤。架橋ポリマーを含むゲル状電解質 ポリエチレン グリコール ジメタクリレート (p(PEGDA)) は 70 °C で合成されました。の 重合反応式を図1(a)に示します。を追加した後、 熱開始剤 AIBN、2 つの活性末端 C=C 基を持つ PEGDA を迅速に 70℃に加熱すると分子間単独重合が起こります。アクティブな AIBNの鎖は分子鎖を相互に、または内部で結合させ、 そして最終的にp(PEGDA)ネットワーク骨格構造を取得し、成功しました その場重合法を使用してゲル状電解質を得る バッテリーの中。図 S1 に示すように、3 つの前駆体溶液は 異なるPEGDA含有量はすべて、LiFePO4ポジティブに対して良好な濡れ性を示しました。 電極シートは、電極間の良好な界面接触を得る鍵となります。 電解質と電極
図。 1 GCEの準備と構造解析
(a) 重合 PEGDAの反応。 (b) GCE-x の光学写真。 (c、d) FT-IR GCE-20、PEGDA、LEのスペクトル。 (e) GCE-x の XRD パターン。カラフル 図はウェブサイトで入手可能
高イオン性のGCEを得るには 導電性、ポリマー内で高度に解離する LiTFSI、 リチウム塩として を使用し、0.2 mol/L LiDFOB を導入して構築しました。 複塩系のゲルネットワーク。 LiDFOBは溶解性に優れており、 熱安定性、特にフィルム形成特性。炭酸の場合 溶媒はリチウム金属アノードと接触しており、多数の緩んだ部分が存在します。 多孔質または樹枝状のリチウム析出層が表面に形成される可能性があります。 リチウム金属の表面。 LiDFOB の導入は、 HFフリーの固体電解質界面(固体電解質)の形成 界面、SEI) 層を形成し、リチウム金属アノードとの適合性を向上させます。 同時に、LiTFSI は金属集電体に腐食作用を及ぼします。 一方、LiDFOB はアルミニウム金属を不動態化し、アルミニウム金属の腐食の影響を軽減します。 集電装置上の LiTFSI。ただし、LiDFOB の単塩電解質は のLiTFSI-LiDFOB二塩電解質よりも高いインピーダンスを示しました。 同じ濃度。図S2に示すように、Li||LiFePO4バッテリーは 1.2 mol/L LiDFOB および LiTFSI-LiDFOB ゲル電解質を使用して組み立てられ、 それぞれ、LiTFSI-LiDFOB 電池のインピーダンスは著しく大きくなりました。
既存の研究結果は、LiTFSI を示しています。 LiDFOB は相乗効果をもたらし、効果的に改善します。 電解質とリチウム金属アノードとの適合性。ジャオ・シュホンら アル。 XPS と FT-IR を使用して、LiTFSI と LiDFOB は正極のアルミニウム集電体を不動態化できます リチウム金属ネガの表面に安定したSEI層を形成します。 リチウム金属電池の長期安定したサイクルを実現する電極。の上 この根拠に基づいて、Liu Yue et al. [26] ハイブリッド分子動力学シミュレーションを使用して、 金属リチウムにおけるLiTFSIとLiDFOBの共同作用機構の研究 LiTFSI の LiDFOB に対する保護効果について説明しました。研究 LiDFOB の B-O 結合は比較的弱く、損傷を受けやすいことが示されています。 破損。 LiDFOB はフリーラジカルの作用により急速に分解し、 リチウム金属と反応して、遊離の LiO 原子とホウ素原子を生成します。ホウ素原子 挿入反応により、電解質中の溶媒分子が 分解し、結果として生じる分子断片は次のものと反応し続けます。 リチウム塩分子断片とホウ素原子。ジリチウム塩系では、 ただし、LiTFSI は「犠牲」に依存して優先的に分解します。 LiDFOBを保護する機構」により、LiDFOBの分解速度は 大幅に減少しました。それにより、遊離の Li2O 原子とホウ素原子の数が減少し、 これにより、SEI 層が最適化され、リチウム金属アノードが保護されます。
図 1(b) に示すように、GCE-x は均一です 透明なゼリー状で、もはや液体ではありません。モノマーをさらに検証するには 重合、FT-IR を使用して LE の化学構造を特徴付け、 PEGDAモノマーとGCE-20。図 1(c) に示すように、3 つのサンプルすべてが次の結果を示しています。 C=O 伸縮振動の典型的な吸収ピーク (~1726 cm-1)。の GCE の 1280 cm-1 の吸収ピークは反対称と エーテル結合の対称伸縮ピーク。 -(CH2CH2)n- であることを示します。 モノマーは重合中に破壊されません。 1095 のピークと 2867 cm∙1 はそれぞれ -COOR と -CH2 に属します。として 図 1(d) に示すように、PEGDA の C=C 結合の特徴的なピークは、 1616 ~ 1636 cm-1 に位置しますが、GCE では消失します。これは、PEGDA が 完全に重合している。
リチウムイオンは内部でのみ移動するため、 GCE の非晶質領域により、電解質の結晶性が低下します。 イオン伝導性の向上に効果的です。図 1(e) は、次の XRD パターンです。 GCE-x。 3種類のサンプルはいずれも独特の回折吸収ピークを持っています 2θ=21°で、調製された電解質に非晶質領域があることを示します 少量の結晶を伴います。 PEGDAの内容としては 増加すると、スペクトルのピーク面積が大幅に増加し、 ゲル電解質の非晶質領域の割合が減少し、 電解液中の非晶質成分の含有量は減少しますが、 イオンの移動を促進します。
2.2 GCE および リチウム金属適合性分析
互換性を調べるために 異なるポリマー含有量の電解質とリチウム金属アノード 電池、GCE-x を使用した Li||Li 対称電池のインピーダンス スペクトル 初期状態の電解質が分析されました (図 S3 を参照)。で 図では、GCE-10 および GCE-20 バッテリーのインターフェース インピーダンス値は次のとおりです。 どちらもそれぞれ 93 Ω と 152 Ω と小型で、GCE-30 のバッテリーは 409 Ω に達します。 これは、ポリマー含有量が高い GCE 中のリチウムイオンの移動には、次のことが必要であることを示しています。 急速な移民の促進にはつながらない、より大きな移民障壁を克服するため。 界面でのリチウムイオンの伝導
Li||Li の過電位の観察 対称電池の充放電サイクル試験により、電位を知ることができます。 このプロセス中にイオンペアの移動によって生成された差、そして リチウムの析出/剥離挙動を評価します。図 S4 は、 GCE-x の Li||Li 対称セルの電圧-時間曲線。試験温度 温度は 25 °C で、バッテリーは定電流で充電および放電されました。 比容量は 0.5 mAh cm-2、電流密度は 0.5 mA cm-2 です。 Li|GCE-10|Li セルの初期過電圧は 22 mV で、電圧は 250 時間後には 137 mV に増加しました。 GCE-30 対称型の過電圧 バッテリーの初期電圧は104mVで、その後過電圧が急激に上昇しました。 後続のサイクルでは、227 時間で 509 mV のピーク値に達し、その後 急激に低下し、バッテリーが内部短絡したことを示しています。で 対照的に、GCE-20 バッテリーは 30 mV 近くの低い過電圧で動作できます。 最も安定した電気化学的性能を持っています。以下に焦点を当てます GCE-20 電解質
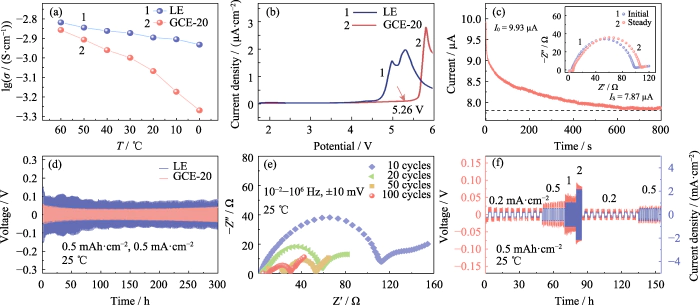
電解質のイオン伝導率 電場内でイオンが移動する能力を直接反映します。の LE および GCE-20 のイオン伝導度は 60、50、40、30、20、10、0 でテストされました。 それぞれ、â。図 2(a) に示すように、GCE-20 のイオン伝導度は 30 °C は 1.00 mS cm-1 であり、試験温度が 60 °C に上昇すると、 導電率は 1.39 mS cm-1 に達します。それは活性化エネルギーがあるからです テスト温度の上昇と運動活動の増加に伴って減少します。 ポリマー鎖セグメントとリチウムイオンが増加します。ただし、移動速度は ポリマー鎖セグメントの変化は明らかに温度の影響を受けるため、 GCE-20ゲル電解質の導電率は電解質よりも大きく変化します
図。 2 GCE-20 の電気化学的性能
(a) イオン性 LEおよびGCE-20の導電率。 (b) LE および GCE-20 の LSV 曲線。 (c) Li|GCE-20|Li セルの現在時間プロファイルと対応する挿入図 ナイキストプロット。 (d) で組み立てられた対称 Li||Li セルの電圧-時間曲線 LEおよびGCE-20; ( e )サイクリング後のLi|GCE-20|Liセルのナイキストプロット。 (f) Li|GCE-20|Li セルの電圧-時間および電流密度-時間曲線。カラフル 図はウェブサイトで入手可能
バッテリーのエネルギー密度の向上 高い動作電圧での電解液の安定性を確保する必要があります。 研究によると、カルボニル配位ポリマーベースの電解質は通常、 広い電気化学ウィンドウと高速動作時の優れた安定性を備えています。 電圧。図 2(b) は、GCE-20 バッテリーの LSV 曲線が変化し始めることを示しています。 5.26Vで大きく変動しており、 GCE-20 ゲル電解質の電気化学窓は 5.26 V に達します。 対照的に、市販の電解液の電気化学窓はわずか 3.92 です。 V. したがって、ゲル状電解質は電気化学的安定性に優れています。 高電圧で。
さらに、リチウムイオンの移動 電解液の数値もリチウムを測る指標の一つです イオン伝導性。リチウムイオンの数の比率として定義されます。 電解質の方向に垂直な断面を通過する 通過するアニオンとカチオンの合計に対する単位時間当たりのリチウムイオン移動量 セクションを通して。数値が大きいほどリチウムの割合が多くなります イオンマイグレーションプロセスでイオンが増加し、マイグレーション効率が高くなります。 図 2(c) は、Li|GCE-20|Li バッテリーのクロノアンペロメトリー曲線です。 挿入図はバッテリーの電気化学インピーダンスの比較です。 テストの前と後。式(1)より、リチウムイオンの移動数は GCE-20の値は0.21です。添加剤の導入または無機ドーピング フィラーはより高いリチウムイオン移動速度を得ることができますが、これは単に バッテリーの充放電速度を向上させるのに有益ですが、 サイクル安定性を向上させます。
充電および放電プロセス中 Li||Li対称電池の場合、電解質中のアニオンとカチオンは 反移民。充電するとリチウムイオンがマイナスに移動します 陰イオンは陽極に移動し、その逆は 放電時は true。したがって、充電と放電のプロセス中に、 正極と負極間のイオン濃度勾配と 内蔵電場が徐々に増加し、反対の動きを妨げます 陰イオンと陽イオンの変化により、内部で濃度分極が発生します。 バッテリーの電圧が変化し、過電位が変化します。図 2(d) に示すように、 Li|GCE-20|Li バッテリーは、300 分間安定したサイクルを行った後、過電圧が 46 mV になります。 h.ただし、テスト中に Li|LE|Li バッテリーによって発生する過電圧 は、Li|GCE-20|Li バッテリー (65~118 mV) よりも大幅に高くなります。これ これは、成長するリチウム樹枝状結晶が一部の箇所でソフトな短絡を引き起こすためです。 内部サイト。結果は、内部の電気化学的挙動が示しています。 GCE-20バッテリーがより理想的です。図 2(e) は対称の EIS テストです。 10、20、50、100 サイクル後のバッテリー。充放電回数としては サイクルが増加すると、バッテリーのインピーダンスが低下する傾向があります。このプロセス中に、 安定したSEI層が電解質とリチウム金属の間に構築されました インターフェース、インターフェース接触が最適化されたため、インターフェース インピーダンスは大幅に減少しました。
25 °C では、Li|GCE-20|Li バッテリーは 電流密度0.2、0.5、1、2、 それぞれ0.2および0.5mA cm-2。図 2(f) は、 このプロセス中の時間の経過に伴う対称セルの過電位。の 低電流密度での過電圧は小さく、比較的安定した状態を維持できます。 電流密度が増加すると、それに応じて過電圧も増加します。 また、プロセス中に電圧が急激に増加/減少することはありません。
リチウムシートコーティングの形態 サイクリング後の堆積/剥離挙動を視覚的に特徴付けることができます。 バッテリーの中にはリチウムが入っています。 Li||Li 対称電池は分解後に分解されました。 容量0.5mAh cm-2、電流で100時間充放電 密度 0.5 mA cm-2、および断面の顕微鏡的形態および リチウム金属シートの表面をFESEMで観察した。図に示すように 図 3(a、b) では、未処理の純粋なリチウム シートの厚さは 353 µm であり、 表面は平らで滑らかです。液体電解質との間の相互作用 リチウム金属は、緩い多孔質の物質を多数堆積させます。 Li|LE|Liのリチウムシート表面のリチウム蒸着層 バッテリーは、ほとんどが細かくて不均一な苔の形をしています。の厚さになると、 リチウム金属シートは 446 µm に増加し、明らかな体積膨張が見られます 効果があり、樹状突起が多数発生します。対照的に、 Li|GCE-20|Li バッテリーのリチウム シートの厚さは 391 μm であり、 表面の蒸着層は緻密で均一であり、微細な分割はありません。 リチウムコーティング(図3(c))。これは、ゲル状電解質が次のことができることを示しています。 リチウム金属負極の体積膨張を効果的に抑制します。 LiDFOB で GCE-20 は、内部のバランスをとるための安定した SEI 層の形成を支援します。 バッテリーの電位を低下させ、リチウムデンドライトの成長を遅らせます。 リチウムの均一な析出。したがって、ある程度まで最適化することができます。 リチウムの析出/剥離挙動を抑制し、リチウム金属アノードを保護します。

図。 3 金属 Li の SEM 画像
断面図(上) (a) 新鮮な金属リチウムとリチウムの堆積の上面図 (下方向) SEM 画像 (b) LE および (c) GCE-20 を使用した対称 Li||Li セルの形態
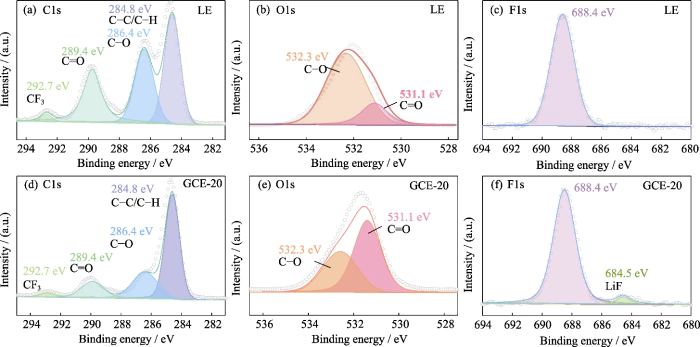
続いて、XPS表面元素分析 表面の SEI 層の組成を調査するために使用されました。 LiTFSI-LiDFOB 複塩系の作用下のリチウム金属アノード GCE。図 S5 は、LE を使用したリチウム金属アノード表面の XPS スペクトルです。 そしてGCE-20。 C1のスペクトル(図S5(a、d))には主に4つの信号ピークがあります。 284.8 eV の C-C/C-H に相当します。 286.4 eV と 289.4 eV の 2 つのピーク はそれぞれ C-O と C=O に対応し、主に カーボネート溶媒(ROCO2-、ROC-など)の分解生成物。の 292.7 eV のピークは CF3 に対応し、主に リチウム塩の分解生成物。 O1s スペクトル (図 S5(b, e)) では、 531.1 eV と 532.3 eV のピークはそれぞれ C=O と C-O に対応します。 C-O の相対含有量が大幅に減少します。これは主に 分解生成物の含有量が減少します。ジョイントの下 LiTFSIとLiDFOBの作用、LiOCH3、Li2O2C2H4などの生成 副産物は制限されています。さらにLE(図S5(e))とは異なり、F1では GCE-20のスペクトル(図S5(f))、LiFの信号ピークは684.5 eVにあり、LiF 緻密で安定した SEI 層の形成を助けることができます。
2.3 電気化学的性能分析 Li||LiFePO4 バッテリー
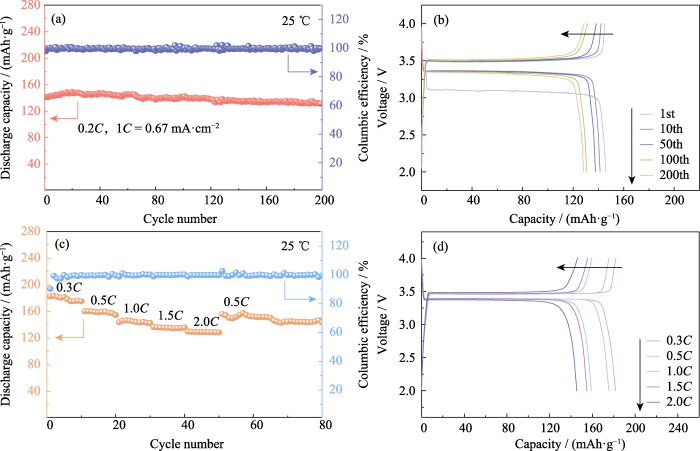
LiFePO4 には高い利点があります。 容量、長いサイクル寿命、優れた安全性を備えた主流のポジティブ製品です。 電極活物質。理論比容量は170mAh・g-1です。で 25 °C、Li|GCE-20|LiFePO4 バッテリーを 200 回充電および放電しました。 0.2C(1C=0.67mA・cm-2)の定電流。図 4(a、b) に示すように、 最初のサイクルの放電比容量は 141.4 mAh・g-1 です。放電 200周目の比容量は131.4mAh・g-1、容量保持率 率は 92.95% に達し、1 ターンの容量減衰は 0.04% 未満です。の LiFePO4の特性に合わせてプラットフォーム電圧が安定しています 電池。電池を評価する重要な指標としてのクーロン効率 サイクル安定性、充電に対するバッテリーの放電容量の比率を指します。 同じサイクル中の容量。の最初のサイクルのクーロン効率 Li|GCE-20|LiFePO4 バッテリーは 97.8% です。 SEI層の形成により 最初のサイクルの放電プロセス中に、不可逆容量の一部が が生成され、最初のサイクルのクーロン効率が低くなります。
図。 4 電気化学的性能 Li|GCE-20|LiFePO4 セル
(a) サイクリング 性能と (b) 0.2C での対応する電圧容量曲線。 (c) レート性能と (d) 対応する電圧容量曲線。カラフル 図はウェブサイトで入手可能
さらに、充放電テスト Li|GCE-20|LiFePO4 に対して 0.3C、0.5C、1C、1.5C、および 0.5C の速度で実行されました 電流を調べてレートパフォーマンスを調べます。図 4(c) に示すように、 電流率は 0.5C、最初のサイクルの放電比容量は バッテリーは160.2mAh・g-1。電流率が増加すると、放電特有の バッテリーの容量が制御可能な範囲で減少します。料金は 2C に増加し、最初のサイクルの比容量は dチャージは130です mAh・g-1。その後、現在のレートは再び 0.5 ℃に戻り、 最初のサイクル放電の比容量は 156.1 mAh・g-1 でした。関連する 電圧と容量の曲線を図 4(d) に示します。プラトー電圧 異なるレートは過電圧の増加を引き起こすことなく安定しており、 バッテリーは良好なレート性能と可逆性を示します。
3 結論
PEGDA ベースの GCE は熱的に開発されました その場で重合を開始します。 FT-IR および XRD 特性解析 電気化学試験と組み合わせた GCE の最適な GCE を選別しました。 配合。電気化学を研究するためにバッテリーをさらに組み立てます 電解液の性能を調べ、電解液の保護効果を分析します。 リチウム金属負極上の電解質を観察することにより、 リチウム金属の微視的な形態と表面元素の特性評価、 説明:
1) によって作成された GCE-x (x=10, 20, 30) その場重合により、電極シートと電解質を十分に濡らすことができます。 PEGDA の質量分率が 20% の場合、電気化学的安定性が最も高くなります。
2) LiTFSI の二リチウム塩系と ポリマーと良好な相互作用を形成できるLiDFOBを導入 コンポーネント。電解液には広い電気化学ウィンドウ (5.26 V) があり、 イオン伝導率 (30 μm、1×10-3 S·cm-1)。同時に、二リチウム塩 システムを使用して安定した SEI 層を構築し、効果的に保護することができます。 リチウム金属アノード。
3) コマーシャルに合わせて GCE-20 を使用する LiFePO4 正極材料、組み立てられた完全なバッテリーは安定して充電でき、 0.2Cの電流で200サイクル放電、容量維持率 92.95% であり、良好なレート性能を示します。
要約すると、この作品は安全かつ GCE の優れた電気化学的性能により、効果的な 安全で安定した高エネルギー密度リチウムの開発ソリューション 金属電池
追加資料:
S1電池準備工程
LiFePO4、ケッチェンブラック、および 目標比率に従って PVDF、溶媒 N-メチルピロリドンを追加 (N-メチルピロリドン、NMP)を十分に撹拌、分散させ、均一で均一な溶液を得る 粘稠な活物質スラリー。スラリーをアルミニウム上にスクレープコーティングした フラットコーターでホイルを塗布し、真空オーブンに移し、80 °C で乾燥させます。 12時間。電極シートをカット後、再度乾燥させてから電極シートに移します。 無水無酸素グローブボックス
ガスケット、破片、リチウム金属シート を負極ケースの中央に順次配置し、 リチウム金属シートの厚さは0.35mmであった。続いて、前駆体 GCE 溶液をネガの表面中央に滴下しました。 ピペットガンを使用して電極 (50 µL) を注入し、次に Celgard 2500 バッテリーを使用します。 セパレーターと正極シート (Celgard 2500 バッテリー セパレーター) 順番に置かれていました。 Li||LiFePO4 バッテリーを組み立てる前に、 正極片の重量を量り、活物質の負荷を記録しました。 LiFePO4 正極の活物質表面負荷は 3.94 でした。 mg cm-2。最後に、バッテリー密閉機でバッテリーを加圧して密閉し、 70 °C の環境に移し、2 時間加熱して開始します。 重合してゲル状の電解質を得る。を確実にするために、 電解液は LiFePO4 ポールピースに完全に浸透します。バッテリーは 組み立て後 1 時間放置します。
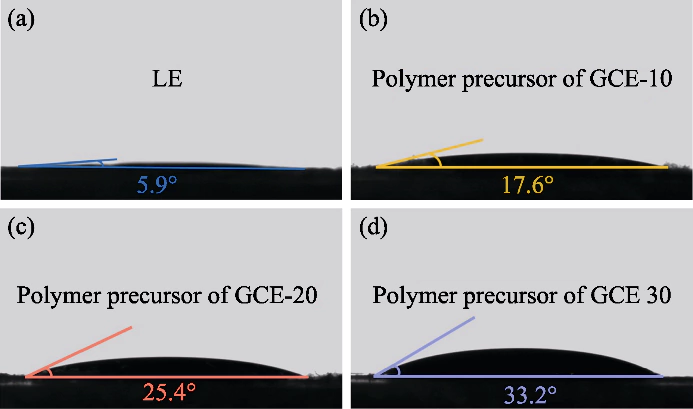
図 S1 ポリマー前駆体溶液と陰極間の接触角
(a) LE; (b) GCE-10; (c) GCE-20; (d) GCE-30
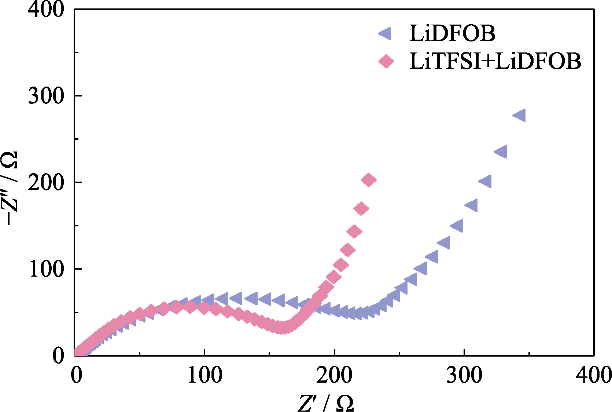
図。 S2 さまざまなリチウム塩を使用して GCE で組み立てられた Li||LiFePO4 セルのナイキスト プロット
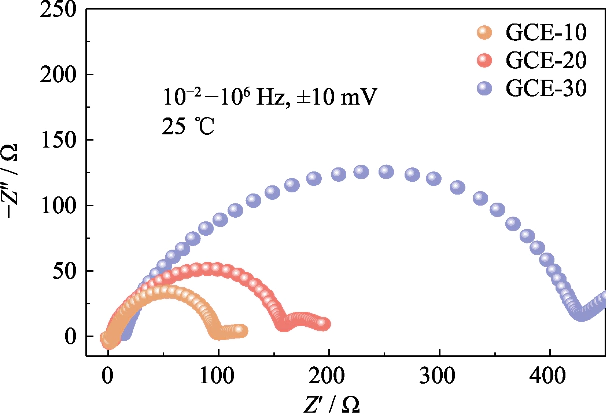
図。 GCE-x 電解質で組み立てられた対称 Li||Li セルの S3 ナイキスト プロット
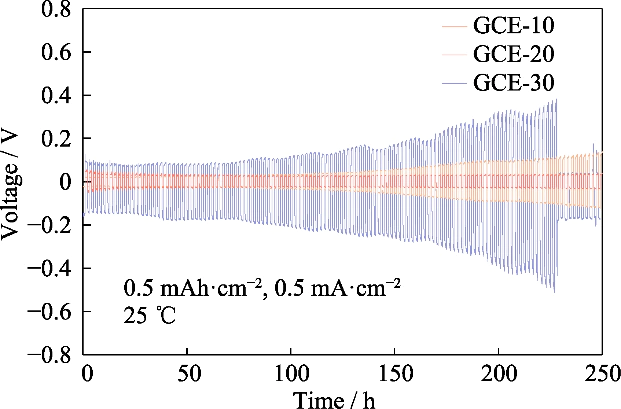
図。 GCE-x 電解質で組み立てられた対称 Li||Li 電池の S4 V電圧時間プロファイル
図。対称 Li||Li セル<373 における金属 Li アノードの S5 XPS スペクトル
(a、d) C1s、(b、e) O1s、(c、f) F1s (a-c) LE および (d-f) GCE-20 を使用した金属 Li アノードの XPS スペクトル
[1] グッドイナフ J B、キム Y.
の課題 充電式リチウム電池
の化学 資料、2010、22(3):587.
[2] ZHAO J、LIAO L、SHI F 他 アル。
表面フッ素化 安定性を高めるための反応性電池負極材料
ジャーナル アメリカ化学会、2017、139(33):11550.
[3] タラスコン J M、アルマンド M.
問題と課題 リチウム二次電池に直面
ネイチャー、2001、414(6861):359.
[4] ZHI J、YAZDI A Z、VALAPPIL G、他。
人工固体 水性リチウムエネルギー貯蔵システム用電解質中間相
科学の進歩、2017、3(9):e1701010.
[5] JUN K、SUN Y、XIAO Y 他 al.
超イオン性リチウム コーナー共有フレームワークを備えた導体
自然材料、2022、21: 924.
[6] LIU J、BAO Z、CUI Y 他 al.
のための道 実用的な高エネルギーロングサイクルリチウム金属電池
自然エネルギー、2019、4(3):180.
[7] ダン B、カマス H、タラスコン J M.
電気エネルギー グリッドのストレージ: 一連の選択肢
サイエンス、2011、334(6058):928.
[8] モージェ A、ジュリアン C M、パオレラ A、他
より良い建物を作る 全固体電池: レビュー
資料、2019、12(23):3892.
[9] マンチラム A、ユ X、ワン S.
リチウム電池 固体電解質によって可能になる化学
自然のレビュー 資料、2017、2(4):16103.
[10] ZHOU D、SHANMUKARAJ D、TKACHEVA A、他 al.
高分子電解質 リチウムベース電池の進歩と展望
化学、2019、5(9):2326.
[11] タンS J、YUE J、TIAN Y F、他
難燃性リン酸塩を強固なポリマーマトリックスにその場でカプセル化 安全・安定な準固体リチウム金属電池を目指して
エネルギー貯蔵 資料、2021、39: 186.
[12] ZHAO Q、LIU X、STALIN S、他 al.
固体ポリマー 二次リチウムの高速界面輸送を内蔵した電解質 電池
自然エネルギー、2019、4(5):365.
[13] ZHOU ZHOU、FENG Y、WANG J 他 al.
堅牢で高度な 安定したリチウム金属電池用の伸縮性イオン伝導性スキン
化学工学 ジャーナル、2020、396: 125254.
[14] ウィルケン S、トレスコウ M、シェアーズ J、他 al.
初期段階 詳細なラマンおよびNMRによるLiPF6ベースのリチウムイオン電池電解質の熱分解 分光法
RSC Advances、2013、3(37):16359.
[15] リュー・F Q、WANG W P、YIN Y X、他
従来のアップグレード 将来のリチウムのためのその場ゲル化による液体電解質 金属電池
科学の進歩、2018、4(10):eaat5383.
[16] XU C、SUN B、GUSTAFSSON T、他 al.
界面層 固体高分子電解質リチウム電池における形成: XPS 研究
材料ジャーナル 化学 A、2014、2(20):7256.
[17] WEI Z、CHEN S、WANG J 他 al.
優れたリチウムイオン 無溶媒による櫛状構造の高分子電解質の伝導 双極型全固体リチウム電池用共重合
材料ジャーナル 化学 A、2018、6(27):13438.
[18] ディ・ノート V、LAVINA S、GIFFIN G A、他
高分子電解質: 現在、過去、未来
エレクトロキメカ アクタ、2011、57(15):4.
[19] XUE Z、HE D、XIE X。
ポリエチレン(エチレン 酸化物)系リチウムイオン電池用電解質
ジャーナル・オブ・マテリアルズ 化学 A、2015、3(38):19218.
[20] マインドマーク J、レイシー M J、ボーデン T、他
超えて PEO-Li+ 伝導性固体高分子電解質の代替ホスト材料
ポリマーの進歩 科学、2018、81: 114.
[21] アラヴィンダン V、グナナーラージ J、マダヴィ S、他 al.
リチウムイオン リチウム電池用導電性電解質塩
Chemistry-A European Journal、2011、17(51):14326.
[22] XU K.
電解質と リチウムイオン電池およびその他の界面
ケミカルレビュー、2014、114(23):11503。
[23] 楊 H、荘 G V、ロス JR P N.
熱安定性 LiPF6 塩とリチウムイオン電池 LiPF6を含む電解液
ジャーナル・オブ・パワー 出典、2006、161(1):573.
[24] LI Q、LIU G、CHENG H 他 al.
低温 リチウムイオン電池の電解質設計: 展望と課題
化学-A ヨーロッパ ジャーナル、2021、27(64):15842.
[25] JIAO S、REN X、CAO R、他 al.
安定したサイクル エーテル電解質中の高電圧リチウム金属電池
自然エネルギー、2018、3(9):739.
[26] LIU Y、YU P、SUN Q、他 al.
予測されたオペランド ホウ素挿入によるリチウムアノードでの重合
ACS Energy Letters、2021、6(6):2320.
[27] CAO W、LU J、ZHOU K 他 al.
有機無機 in-situ重合による安定したLi金属アノード用の複合SEI
ナノエネルギー、2022、95: 106983.
[28] チェン S、スミス D M, LI C Y.
ナノスケールはどのようにして実現されるのか 結晶構造は固体高分子電解質のイオン輸送に影響を与えますか?
高分子、2014、47(12):3978。
[29] ヨハンソン P.
第一原則 アモルファス高分子電解質のモデリング: Li+-PEO、Li+-PEI、および Li+-PES 複合体
ポリマー、2001、42(9):4367.
[30] SUN B、MINDEMARK J、EDSTRÃM K、他 al.
ポリカーボネートベース リチウムイオン電池用固体高分子電解質
ソリッド ステート イオニクス、2014、262: 738.
[31] シルバ・M M、BARROS S C、SMITH M J、他
の特徴付け ポリ(トリメチレンカーボネート)とリチウムをベースとした固体高分子電解質 テトラフルオロボレート
エレクトロキメカ アクタ、2004、49(12): 1887。
[32] バルボーザ P、ロドリゲス L、シルバ M 金属。
の特徴付け pTMCnLiPF6 固体高分子電解質
ソリッドステートイオンニクス、2011、193(1):39.